全国の基幹的医療機関に配置されている『ロハス・メディカル』の発行元が、
その経験と人的ネットワークを生かし、科学的根拠のある健康情報を厳選してお届けするサイトです。
情報は大きく8つのカテゴリーに分類され、右上のカテゴリーボタンから、それぞれのページへ移動できます。
生物学的製剤基準と国家検定
※情報は基本的に「ロハス・メディカル」本誌発行時点のものを掲載しております。特に監修者の肩書などは、変わっている可能性があります。
~ 審査と検定の流れを再確認(下) ~
(シリーズ どうなってるの予防接種!?)
前回、ワクチンのような生物学的製剤の場合、通常の医薬品で承認前に行われる審査に加えて、承認後も生物学的製剤基準に適合するか否かの国家検定が行われていることを説明しました。
前回は少し話を端折り過ぎたかもしれません。ワクチンに関しては、以下のような審査の流れになっています。
まず、メーカーから独立行政法人・医薬品医療機器総合機構(PMDA)へ製造販売承認申請書が提出されます。その中には、製造方法、品質管理項目が記述されています。
品質管理項目には、培養温度や遠心分離機の回転数、培養時間などといった単純なものの他に、試験を行って確認しないといけないものがあります。この試験は、メーカーによる自家試験として行われ、自家試験を正しく実施するために手順書も作成されます。
製造方法や規格についてPMDAで検討した後、その結果について国立感染症研究所(感染研)も意見を求められます。後に、その製造手順や規格を簡略化したものが、生物学的製剤基準の原案となります。
つまりメーカーの出してきた案に当局が手を加えることになります。「試行錯誤して開発したメーカーが、最もノウハウを持っているから」と、感染研の加藤篤・検定検査品質保証室長は説明します。
「足りないと思われるもの、感染研の検査手法と異なるものについては、やりとりして修正を求めています」(同)。
承認事項の一部
承認審査中、PMDAの依頼を受けて感染研は、試験製造品を使って必要と思われる試験を手順書に従って検査(承認前検査と言います)します。この承認前検査で申請書に書かれた結果が再現されると、手順書は適合と判断され、承認を迎えます。
承認事項の中でも、特に定める必要があると見なされた製造手順、試験方法と品質基準は、厚生労働省(以下、厚労省)によって生物学的製剤基準として定められます。
 生物学的製剤基準は、薬事承認後速やかに薬事法42条1項の規定に基づく厚労省告示として発令され、効力を発揮します。この告示は、古いファイルに、どんどん新たなページが足されていくようなイメージ(図1)ですが、何年かに一度、改訂されます。技術の進歩などで精度の高い試験方法が出てきたり、文言の全体の整合性をとるといった必要性からで、現在も全般的な見直し作業が行われおり、今年度中に改訂版が出る予定だそうです。
生物学的製剤基準は、薬事承認後速やかに薬事法42条1項の規定に基づく厚労省告示として発令され、効力を発揮します。この告示は、古いファイルに、どんどん新たなページが足されていくようなイメージ(図1)ですが、何年かに一度、改訂されます。技術の進歩などで精度の高い試験方法が出てきたり、文言の全体の整合性をとるといった必要性からで、現在も全般的な見直し作業が行われおり、今年度中に改訂版が出る予定だそうです。
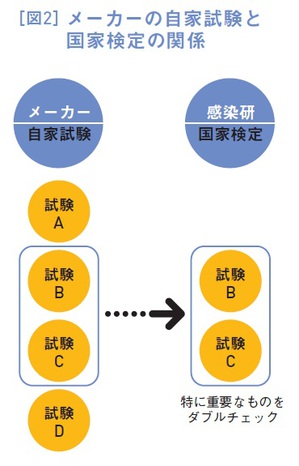 そして、生物学的製剤基準に含まれる自家試験の項目のうち、一部の重要な項目が、厚労省により国家検定の項目と定められます(検定規準・図2)。
そして、生物学的製剤基準に含まれる自家試験の項目のうち、一部の重要な項目が、厚労省により国家検定の項目と定められます(検定規準・図2)。
最長130日の国家検定
承認が下りて本製造が始まると、製品ロットごとに、メーカーが個別のワクチン原液や最終バイアルの自家試験を行います。と同時に、先ほど説明した項目については、感染研がダブルチェックの国家検定を行います。
製品ロットと言われてもピンと来ないと思いますが、製造の一連の流れの中で、小分けしただけと見なせる均一な製品の集合を指すとのこと。ずっと同じタンクの中に入ってたものというイメージでしょうか。だいたい1ロットが数万接種分になるそうです。
国内メーカー製品の自家試験が国内で行われるのは当然のことですが、海外メーカー製品の場合、上流製造工程の自家試験は製造国で行われ、最終小分け製品(ビン詰め製品)の自家試験の一部は国内で行われます。
ロットから抜き出されたサンプルが国家検定を受けている間、同じロットの他のバイアル群は封印され、生物学的製剤基準に則って保存されています。
国家検定に最長で要する期間(標準的事務処理期間と呼ばれます)は、あらかじめ厚労省から課長通知の形で示されます。多くのワクチンが該当するのは60日ですが、短いものから長いものまで様々です。長いワクチンとしては、3種混合DPTワクチンと不活化ポリオワクチンを加えた4種混合(最終段階)があり、その長さは130日です。
130日と言えば4カ月以上。なぜ、そんなに長くかかるのかというと、ワクチンをマウスやラット、モルモットあるいはウサギといった動物の体内に入れて、その反応を確かめるといった時間がかかる方法であることと、万が一試験がうまくいかなかった時、やり直しの準備に時間を要するためだそうです。
流行に間に合わなくなる可能性がある季節性インフルエンザワクチンは、標準的処理期間が35日と短くなっています。

