全国の基幹的医療機関に配置されている『ロハス・メディカル』の発行元が、
その経験と人的ネットワークを生かし、科学的根拠のある健康情報を厳選してお届けするサイトです。
情報は大きく8つのカテゴリーに分類され、右上のカテゴリーボタンから、それぞれのページへ移動できます。
ワクチンの通る道
※情報は基本的に「ロハス・メディカル」本誌発行時点のものを掲載しております。特に監修者の肩書などは、変わっている可能性があります。
~ 審査と検定の流れを再確認(上) ~
(シリーズ どうなってるの予防接種!?)
ワクチンの安全性・有効性がどのように担保されているか、また、その方法が通常の医薬品とは少し違うということ、ほとんどの方はご存じないと思います。いったん基本に立ち返って、確認してみましょう。
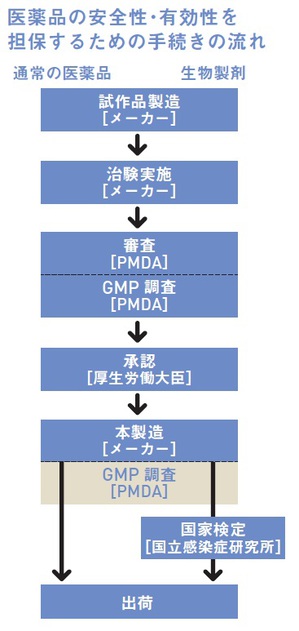 字面を追うだけだと、なかなか理解しづらいと思うので、図を眺めながらお読みください。
字面を追うだけだと、なかなか理解しづらいと思うので、図を眺めながらお読みください。
ここから説明するのは、メーカーが企業努力として品質を守ろうとするのは大前提として、当局(太字の機関が関与します)がどのように監視し担保していくかという話です。
まず、通常の医薬品の場合です。
メーカーが治験を通じて人での有効性・安全性を確かめ、独立行政法人・医薬品医療機器総合機構(PMDA)の審査を経て、厚生労働省の薬事承認を得ます。(興味があったら『ロハス・メディカル』06年10月号「治験」特集も読んでみてください)
医薬品は主に工業製品なので、審査で最終製品と製法の有効性・安全性が確かめられたなら、以後はPMDAが工場などを随時査察して、原料や製法が審査時と変更されていないか確認する(GMP調査と言います)ことで、本製造分も審査時と同じものが生産されていると見なし、安全性・有効性を担保します。
これに対してワクチンは、血液製剤、トキソイド、抗毒素製剤などと共に生物製剤と呼ばれ、医薬品と基本は変わらないものの、もう一つ国家検査が加わります。単純な工業製品ではなく、生物の細胞などを原料や製造過程そして品質検査にも用いるため、最終製品の品質に必ずバラつきが出るからです。
そこで、その試験方法とバラつきの許容範囲(規格)を定めた「生物学的製剤基準」が設定されています。その基準と適合するか、国立感染症研究所が製品ロットごとに検査して、適合した製品だけ「国家検定合格証書」というシールを貼られて、出荷を許されます。
基準? 検定?
さらっと書いてしまいましたが、何が何だか分からないというのが正直なところだと思います。
ワクチンなどの生物製剤に特有の生物学的製剤基準って一体何でしょう。国家検定って一体何をしているんでしょう。製品ロットって何でしょう。
百聞は一見に如かずなので、単抗原不活化ポリオワクチンの生物学的製剤基準を一部抜粋してみましょう。

こういうものが、ワクチン1種類ずつ定められています。複数のメーカーが同じ疾病対象のワクチンを製造して同じ基準が用いられている場合もあります。
そして、ここに書かれた試験方法の中で、特に定められた試験と審査を行って製品の品質が許容範囲内にあることを確認するのが、国家検定です。
「基準」が大きすぎて紙幅が尽きてしまったので、続きは次号へ回します。

